Energía existente y energía potencial
Los solventes deben vencer las fuerzas intermoleculares de los solutos para poder disgregarlas. Para que esto sea posible es necesario que se produzca una interacción de las moléculas del disolvente con las del soluto, que recibe el nombre genérico de solvatación. Cuando una sustancia se sumerge en un disolvente apropiado, las moléculas (o iones) situadas en la superficie del sólido son rodeadas por las del disolvente; este proceso lleva consigo la liberación de una cierta cantidad de energía que se cede en parte a la sustancia que se disuelve y permite a algunas de sus partículas componentes desprenderse de ella e incorporarse a la disolución. La repetición de este proceso produce, al cabo de un cierto tiempo, la disolución completa del solutos. En algunos casos, la energía liberada en el proceso de solvatación no es suficiente como para romper las fuerzas intermoleculares.
Para que la energía de solvatación tome un valor considerable es necesario que las interacciones entre las moléculas del soluto y entre las del disolvente sean de la misma naturaleza. Sólo así el fenómeno de la solvatación es lo suficientemente importante como para dar lugar por sí solo a la disolución del soluto.
Junto con los factores de tipo energético, como los considerados hasta ahora, que llevan a un sistema sólido/líquido o líquido/líquido a alcanzar un estado de menor energía potencial, otros factores determinan el que la disolución se produzca o no de forma espontánea. Esta afirmación está respaldada por dos tipos de fenómenos: en primer lugar la existencia de procesos de disolución que implican una absorción moderada de energía del medio, lo cual indica que el sistema evoluciona hacia estados de mayor energía interna; en segundo lugar sustancias apolares como el tetracloruro de carbono (CCl4), aunque poco, se llegan a disolver en disolventes polares como el agua.
La disolución de un material en un disolvente viene dado por un cambio en la energía libre:
ΔGdis =ΔHdis −TΔSdis
Para que el material se disuelva ΔG debe ser negativo. El término de la entalpía de disolución se relaciona con la intensidad relativa de las fuerzas intermoleculares (puentes de hidrógeno, fuerzas de Van der Waals: dispersión de London y dipolo-dipolo generalmente) entre las moléculas de soluto y de disolvente. Dado un soluto S y un disolvente D, si la intensidad de las fuerzas S-D son mayores que las que se establecen entre las moléculas de soluto S-S y de disolvente D-D, la entalpía de disolución es negativa.
Fuerzas intermoleculares y polaridad de las moléculas
Como se acaba de ver en el inciso anterior, las fuerzas intermoleculares son parámetros para muchas ecuaciones que predicen la realización de una reacción, y es que de éstas también dependerán la mayoría de las propiedades de los solventes, y su acción de disolver
Por ejemplo, en los procesos de disolución de un polímero rara vez se utiliza un único disolvente sino una mezcla de dos o más disolventes, ya que el disolvente principal puede no tener un poder disolvente muy fuerte como para disgregar toda la molécula, y para eso se le agregan DISOLVENTES LATENTES (como un alcohol).
Ejemplo ilustrativo
Una mezcla de alcohol-hexano presenta buenas cualidades para disolver una poliamida. El alcohol (que vendría a ser el OH-R) forma enlaces por puentes de hidrógeno con los grupos amida, mientras que el hexano interactúa con la cadena hidrocarbonada del polímero por fuerzas de dispersión de London. De esta forma, uno puede saber qué solvente, o mezcla de solventes, utilizar para lograr una disolución.
El ejemplo ilustrativo explica el dicho de que “lo semejante disuelve a lo semejante”. Los disolventes apolares como el agua son apropiados para solutos polares como los sólidos iónicos o los sólidos formados por moléculas con una cierta polaridad eléctrica. Por su parte, los disolventes apolares, como el benceno (C6H6), disuelven las sustancias apolares como las grasas.
Ejemplo ilustrativo
Las grasas y aceites son ésteres cuya hidrólisis en medio alcalino produce mezclas de sales sódicas de ácidos grasos que se conocen con el nombre de JABONES:

Colocamos la fórmula:

Los jabones tienen dos zonas importantes
1) ZONA POLAR.- La fuerte acción polar del grupo CARBOXILATO (COO-) es una zona afín al agua o Hidrófila, formando puentes de hidrógeno con el agua y siento disuelta por esta.
2) ZONA APOLAR.- La zona polar se conoce como Hidrófoba o repelente al agua y está representada por la cadena carbonada. Esta zona se disolverá en las grasas o aceites, ya que estos son compuesto apolares.
La longitud de la cadena carbonada determinará la fuerza de la zona apolar de la molécula, ya que si el número de átomos es menos a 12, esta zona no podrá equilibrar la fuerte acción polar del carboxilato, aparte que las moléculas de grasao aceite son moléculas grandes de bastante superficie de contacto, por lo tanto necesitan disolverse zonas apolares largas que también contengan grandes superficies de contacto, para que así puedan interactuar mediante las fuerzas de London.
Aquí podemos apreciarla interacción de las moléculas de jabón (COLOR ROJO) con las moléculas de agua (COLOR AZUL) y con las moléculas de ácido esteárico (COLOR VERDE), que es una grasa que se encuentra en las carnes. Podemos ver la fomación de puentes de hidrógeno cerca de la zona polar del Carboxilato, y también vemos las cadenas carbonadas saturadas de la grasa y del jabón interactuando entre sí mediante fuerzas de London
.png)
Viscosidad y tensión superficial
Obviamente nosotros esperamos que los solventes diluyan a los solutos y disminuyan su viscosidad; pero no siempre quien reduce la viscosidad será el solvente adecuado, por ejemplo, en soluciones muy diluidas, la viscosidad disminuye si el disolvente disuelve mal a la sustancia, lo que queremos es que la disolución sea buena, en cambio si el solvente disuelve bien al soluto, las moléculas estarán más extendidas propocionando más viscosidad.
Sin embargo, en soluciones concentradas, las moléculas del soluto se disgregan y el mejor solvente será quien proporcione menos viscosidad.
Otro factor a tener en cuenta es la tensión superficial del disolvente.
Sabemos que la Tensión superficial es una fuerza que hace que las superficie de los líquidos se comporten como una capa elástica, debido a las fuerzas intermoleculares SÓLO DE ATRACCIÓN que experimentan las moléculas del líquido en la superficie.
Esta influye en el brillo, en la textura de la superficie, en la flotación de los pigmentos y en la adherencia de la película (capa exterior de la solución). La flotación de pigmentos (pequeñas partículas que cambian el color de la luz que reflejan por medio de la adsorción de color) es un fenómeno en el cual una pintura que contiene dos o más pigmentos se seca de tal manera que uno de ellos se separa de los otros (disolución no homogénea) y se concentra en forma de rayas sobre la superficie de la película (flota). El disolvente o mezcla de disolventes debe evitar este problema, ya que los solventes deben interactuar de manera equivalentes con cualquier sustancia que diluya en la solución.
Los disolventes tienen tensiones superficiales que oscilan de 18.10-5 Kg.m/s2 para los hidrocarburos alifáticos, y hasta 30.10-5 Kg.m/s2 para los disolventes oxigenados. Estos valores son inferiores a la tensión superficial de algunos compuestos orgánicos, por lo que:
Fuerza de Tensión superficial disolvente > fuerza de tensión superficial de soluto
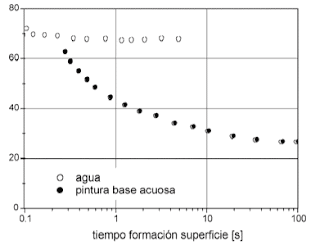
Como consecuencia el disolvente disminuye la tensión superficial de la solución, moja la superficie del soluto y facilita la formación de la película. Si la formación de la película es buena hay mayor humectación de la superficie, lo que es esencial para una buena adherencia. Esto se debe a que las moléculas se aproximan lo suficiente para que se formen enlaces de adherencia (enlaces intermoleculares entre la superficie y las moléculas de disolvente). Varios recubrimientos se aplican como dispersiones en agua y dado que el agua tiene una tensión superficial muy elevada de 72,7.10-5 Kg.m/s2 es necesario añadir tensoactivos para que esta disminuya y permita una mejor disolución.

Aquí vemos un tensoactivo en agua: el tiempo de formación de la película de la superficie disminuye a medida que se reduce la tensión superficial del solvente, y permite una mejor disolución
Punto de ebullición
Estamos viendo una relación del punto de ebullición de los disolventes según su número de carbonos.

Sabemos que el punto de ebullición permite realizar separaciones de componentes en una mezcla, pero también debemos tener en cuenta que el punto de ebullición aumenta en cualquier solución cuando el soluto es no volátil, debido a que, al ser el soluto no volátil, la solución generará menor presión de vapor con respecto al solvente puro, por lo que será necesario calentar a una temperatura más alta para conseguir que la presión de vapor sea igual a 1 atmósfera. Esto supone que la temperatura de ebullición del solvente será más alta.
Punto de fusión
Disminución del punto de congelación: Se observó que el agua de mar funde a menor temperatura que el agua pura. Esto se debe a la existencia de sales, o sea, un soluto.
Existe un equilibrio dinámico entre las partículas que solidifican y las partículas que se fusionan. Cuando se añade un soluto este equilibrio dinámico se rompe ya que las moléculas del soluto congelan a menos velocidad. Es necesaria una disminución de la temperatura para alcanzar un nuevo equilibrio.
Densidad de disolventes
Generalmente los solventes tienen menor densidad que el agua, excepto algunos como el Cloruro de metileno o Cloroformo, que son más densos y viscosos que el agua. Generalmente, debido a la baja inflamabilidad de los compuestos clorados, se usa en la limpieza de metal, en la industria electrónica o como agente de limpieza en seco.
Poder disolvente de los disolventes
El poder disolvente varía con la temperatura y en una mezcla de disolventes rara vez es el promedio de los valores de los componentes individuales. Los líquidos de moléculas pequeñas son mejores disolventes que los de moléculas grandes y, en general, proporcionan disoluciones de menor viscosidad. Así, en una serie homóloga hay una disminución del poder disolvente y un incremento de la viscosidad al aumentar el peso molecular.
TABLA DE ALGUNAS PROPIEDADES FÍSICAS DE LOS PRINCIPALES SOLVENTES
Índice de polaridad / Disolvente / Viscosidad cP, 20ºC / Pto. de ebu.ºC (1 atm)
-0.3 / N-decano / 0.92 / 174.1
-0.4 / Iso-octano / 0.50 / 99.2
0.0 / N-hexano / 0.313 /68.7
0.0 / Ciclohexano / 0.98 / 80.7
1.7 / Éter butílico / 0.70 / 142.2
1.8 / Trietilamina / 0.38 / 89.5
2.2 / Éter isopropílico / 0.33 / 68.3
2.3 / Tolueno / 0.59 / 100.6
2.4 / P-xileno / 0.70 / 138.0
3.0 / Benceno / 0.65 / 80.1
3.3 / Éter bencílico / 5.33 / 288.3
3.4 / Cloruro de metileno / 0.44 / 39.8
3.7 / Cloruro de etileno / 0.79 / 83.5
3.9 / 7Alcohol butílico / 3.00 / 117.7
3.9 / Butanol / 3.01 / 177.7
4.2 / Tetrahidrofurano / 0.55 / 66.0
4.3 / Acetato de etilo / 0.47 / 77.1
4.3 / 1-propanol / 2.30 / 97.2
4.3 / 2-propanol / 2.35 / 117.7
4.4 / Acetato de metilo / 0.45 / 56.3
4.5 / Metiloetilcetona / 0.43 / 80.0
4.5 / Ciclohexanona / 2.24 / 155.7
4.5 / Nitrobenceno / 2.03 / 210.8
4.6 / Benzonitrilo / 1.22 / 191.1
4.8 / Dioxano / 1.54 / 101.3
5.2 / Etanol / 1.20 / 78.3
5.3 / Piridina / 0.94 / 115.3
5.3 / Nitroetano / 0.68 / 114.0
5.4 / Acetona / 0.32 / 56.3
5.5 / Alcohol bencílico / 5.80 / 205.5
5.7 / Metoxietanol / 1.72 / 124.6
6.2 / Acetonitrilo / 0.37 / 81.6
6.2 / Ácido acé tico / 1.26 / 117.9
6.4 / Dimetilformamida / 0.90 / 153.0
6.5 / Dimetilsulfoxida / 2.24 / 189.0
6.6 / Metanol / 0.60 / 64.7
7.3 / Formamida / 3.76 / 210.5
9.0 / Agua / 1.00 / 100.0















.png)